Важки (різноваги) — це будь-які тіла з відомою масою для вимірювання маси інших тіл.
Ви вже знаєте, що атоми — надзвичайно маленькі частинки. Маса найважчих атомів становить близько \(0,0000000000000000000001\) г ( г). Певна річ, що для зважування атомів і важки мають бути розміром з атом. Сьогодні «важком» для визначення маси мікрочастинок прийнято вважати маси атома Карбону-\(12\). Такий «важок» називають атомною одиницею маси, скорочено а. о. м.
Зрозуміло, що для зважування атомів звичайні терези використовувати неможливо. Сьогодні для визначення маси атомів і молекул використовують складні прилади — мас-спектрометри.
Маси атомів порівнюють із \(1\) а. о. м.: таку масу називають відносною атомною масою й позначають (індекс r — від англ. relative — відносний).
Відносна атомна маса — це відношення маси атома певного хімічного елемента до \(1/12\) маси атома Карбону-\(12\) ().
Для хімічного елемента Е:
1 .
Відносна атомна маса — безрозмірна величина, оскільки вона є відношенням двох величин з однаковою розмірністю.
Отже, для визначення відносної атомної маси певного атома слід порівняти його масу з атомною одиницею маси.
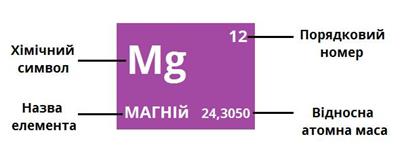
Сьогодні відносні атомні маси майже всіх хімічних елементів визначені з високою точністю й наведені в періодичній таблиці:
Джерела:
Хімія: підруч. для 8-го кл. закл. заг. серед. освіти / Григорович О., Недоруб О. — Київ, Харків: Ранок, 2025. с. 25-32.
Хімія: підруч. для 8-го кл. закл. заг. серед. освіти / Ярошенко О., Коршевнюк Т. — Київ: Оріон, 2025. с. 21-24.
Хімія: підруч. для 8-го кл. закл. заг. серед. освіти / Мідак Л., Кузишин О., Пахомов Ю., Буждиган Х. — Тернопіль: Астон, 2025. с. 31-39.
Хімія: підруч. для 8-го кл. закл. заг. серед. освіти / Лашевська Г. — Київ: Літера ЛТД, 2025. с. 5-11.
Хімія: підруч. для 8-го кл. закл. заг. серед. освіти / Попель П., Крикля Л. — Київ: Академія, 2025. с. 6-10.
