Зі збільшенням концентрації реагуючих речовин відбувається більша кількість зіткнень, що призводять до хімічної взаємодії частинок речовин між собою і збільшенню швидкості реакції.
Збільшуючи концентрацію реагенту, збільшують кількість його частинок у реакційній суміші. Таким чином можна збільшити швидкість хімічної реакції.
Швидкість більшості реакцій зростає із підвищенням температури.
Якби всі частинки, що стикаються реагували б одна з одною, реакція була б подібна до вибуху!
Але частина зіткнень не призводить до утворення нових речовин (а):
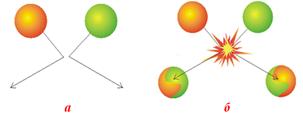
Реакція відбувається лише в результаті ефективних зіткнень (б) частинок, що мають надлишкову енергію — енергію активації.
Цієї енергії достатньо для розриву або ослаблення зв'язків, що може призвести до перебудови атомів у нові молекули.
При підвищенні температури частка активних молекул зростає; збільшується кількість ефективних зіткнень. Таким чином, швидкість хімічної реакції зростає.
