Хімічний елемент
Карбон — хімічний елемент № \(6\). Він розташований у \(IVА\) групі Періодичної системи.
.
На зовнішньому шарі атома Карбону містяться чотири валентних електрони, і до його завершення не вистачає чотирьох електронів. Тому в сполуках з металами для Карбона характерна ступінь окиснення \(-4\), а при взаємодії з більш електронегативними неметаллами він проявляє позитивні ступені окиснення: \(+2\) або \(+4\).
У природі Карбон зустрічається як у вигляді простих речовин, так і у вигляді сполук. У повітрі міститься вуглекислий газ \(CO_2\). У земній корі поширені карбонати(наприклад, \(CaCO_3\) утворює крейду, мармур, вапняк). Горючі копалини (вугілля, торф, нафта, природний газ) складаються з органічних сполук, головним елементом яких є Карбон.
Карбон належить до життєво важливих елементів, оскільки входить до складу молекул усіх органічних речовин.
Прості речовини
Карбон утворює декілька алотропних видозмін, з яких найбільш відомими є алмаз і графіт. Інші відомі алотропні модифікації Карбону — це карбін, фулерени, графен, нанотрубки, тощо.
Алмаз має атомну кристалічну ґратку. Кожен атом Карбону в алмазі зв'язаний чотирма міцними ковалентними зв'язками з сусідніми атомами, розташованими у вершинах тетраедра.
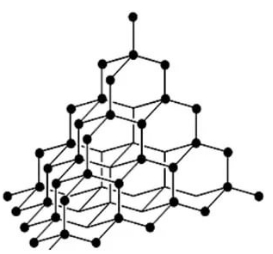
Завдяки такій будові алмаз — найтвердіша з усіх відомих природних речовин. Усі чотири валентних електрони кожного атома Карбону беруть участь в утворенні зв'язків, тому алмаз не проводить електричний струм. Це безбарвна прозора кристалічна речовина, добре заломлює світло.

Графіт теж має атомну кристалічну ґратку, але ґратка графіту є шаруватою. Кожен атом Карбону сполучений міцними ковалентними зв'язками з трьома сусідніми атомами. Утворюються плоскі шари з шестикутників, які між собою слабо зв'язані. Один валентний електрон у атома Карбону залишається вільним.
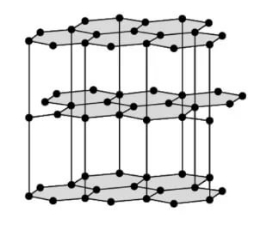
Графіт є темно-сірою речовиною з металічним блиском, жирний на дотик. На відміну від алмазу, графіт непрозорий, проводить електричний струм і залишає сірий слід на папері. Графіт має дуже високу температуру плавлення (\(3700\) °С).

Алмаз і графіт можуть взаємоперетворюватися. При сильному нагріванні без доступу повітря алмаз чорніє і перетворюється на графіт. Графіт можна перетворити на алмаз при високій температурі і великому тиску.
З найдрібніших частинок графіту складаються сажа, деревне вугілля та кокс. Сажа утворюється при неповному згорянні палива. Деревне вугілля отримують при нагріванні деревини без доступу повітря, а кокс — переробкою кам'яного вугілля.
Деревне вугілля має пористу будову і має здатність поглинати гази і розчинені речовини. Така властивість називається адсорбцією.

Карбін за фізичними властивостями схожий на графіт і іноді трапляється в ньому у вигляді білих прожилок. Карбін володіє напівпровідниковими властивостями. Він має лінійну будову:
або .
Фулерени були відкриті у \(1985\) році групою американських і британський учених. Фулерени — це тверді кристалічні речовини, які на відміну від інших алотропних модифікацій, розчиняються в органічних розчинниках з утворенням яскраво забарвлених розчинів. Молекули фулеренів являють собою сфери або еліпсоїди.
Графен — двовимірна структура, утворена шаром атомів Карбону завтовшки в один атом. За певними оцінками графен має велику механічну міцність та рекордно велику теплопровідність і рухомість електронів. Він має перспективи застосування в наноелектроніці та, можливо, замінить силіцій у комп'ютерних мікросхемах.
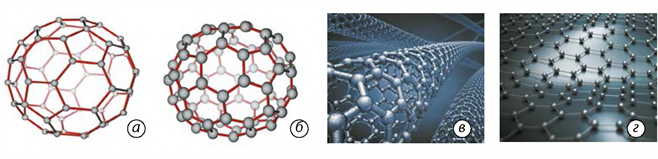
Будова алотропних модифікацій Карбону: а — фулерен ; б — фулерен ; в — нанотрубка; г — графен.
Джерела:
Хімія (рівень стандарту) : підруч. для 11 кл. закл. загал, серед, освіти / Олексій Григорович. — Харків : Вид-во «Ранок», 2019. с. 141 — 142.