Окисно-відновними реакціями називаються хімічні реакції, які протікають зі зміною ступенів окиснення атомів хімічних елементів або йонів, що утворюють реагуючі речовини.
Загальна схема окисно-відновної реакції (ОВР) виглядає наступним чином:
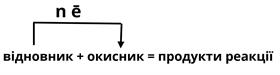
Зверни увагу!
Відбуваються одночасно два процеси: окиснення і відновлення.
Приклад:
Розглянемо схему ОВР взаємодії заліза з хлоридною кислотою:
.
При цьому катіон Гідрогену приймає електрони:
;
атом Феруму віддає електрони:
.
Таким чином, у даній реакції йон Гідрогену є окисником, сам при цьому відновлюється. Відбувається процес відновлення Гідрогену до простої речовини. Ступінь відновлення атомів Гідрогену знижується.
Залізо є відновником. Відбувається окиснення атомів Феруму, його ступінь окиснення підвищується.
