У Періодичній системі хімічних елементів метали містяться у головних (А) і побічних (Б) групах.

Отже, до металічних належать усі елементи побічних підгруп, лантаноїди, актиноїди та елементи, що лежать у лівому нижньому куті періодичної таблиці, нижче діагоналі \(H-B-Si-As-Te-At.\)
Назви простих речовин металічних елементів, у переважній більшості співпадають з назвами елементів. Проте, є і виключення.
Назви металічних елементів і простих речовин, що не співпадають:
| Хімічний елемент | Проста речовина |
| Ферум, | залізо |
| Купрум, | мідь |
| Аргентум, | срібло |
| Станум, | олово |
| Аурум, | золото |
| Меркурій, | ртуть |
| Плюмбум, | свинець |
| Бісмут, | вісмут |
В електронній оболонці атомів металічних елементів на зовнішньому енергетичному рівні, як правило, міститься від \(1\) до \(3\) електронів. Виняток становлять лише метали \(IVА\), \(VА\) і \(VIА\) групи, у яких на зовнішньому енергетичному рівні містяться, відповідно, чотири, п'ять або шість електронів.
Радіуси атомів металічних елементів є більшими, ніж у атомів неметалічних елементів того самого періоду. Завдяки віддаленості позитивно зарядженого ядра, атоми металічних елементів погано утримують свої валентні електрони (електрони зовнішнього енергетичного рівня).
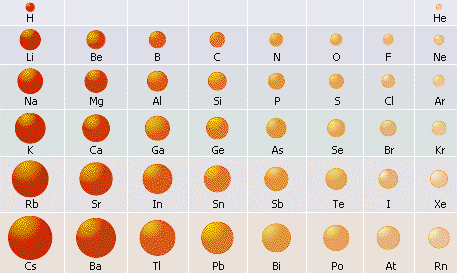
Характер зміни радіусів атомів хімічних елементів у періодах і у групах. Радіуси атомів металічних елементів є набагато більшими, ніж радіуси атомів неметалічних елементів, що містяться у тому самому періоді.
Головна відмітна властивість металічних елементів — це їх порівняно невисока електронегативність (ЕН) у порівнянні з неметалічними елементами.
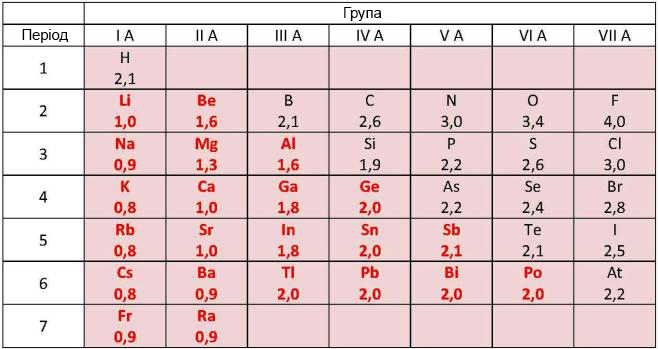
Величини відносних електронегативностей (ВЕН) деяких хімічних елементів (по Л. Полінгу). ВЕН металічних хімічних елементів (виділені чорним кольором) поступається відповідній величині неметалічних хімічних елементів.
Атоми металів, вступаючи у хімічні реакції, здатні лише віддавати електрони, тобто окиснюватися, отже в ході перетворень можуть проявляти себе виключно як відновники.